En quoi consiste la recherche sur les vaccins ?
Un vaccin est une substance capable de protéger très efficacement contre une maladie infectieuse. La mise au point d’un nouveau vaccin est très importante quand :
- la maladie peut être grave voire mortelle, et se transmet facilement, par exemple la Covid-19 ;
- la maladie est grave, transmissible et elle nécessite un traitement à vie, par exemple l’infection à VIH/sida ;
- la maladie peut être grave chez certaines personnes et elle est très contagieuse, par exemple la grippe chez les personnes âgées, la rougeole chez les enfants, la rubéole chez la femme enceinte, la coqueluche chez les nourrissons, la tuberculose… ;
- la maladie peut être grave, touche un grand nombre de personnes et elle se transmet par un vecteur comme le moustique (par exemple la dengue ou le paludisme) ;
- la maladie peut se compliquer de cancer (par exemple hépatite B et cancer du foie, infections à HPV et cancer du col de l’utérus).
La recherche sur les vaccins avance en continu et permet de mettre au point de nouveaux vaccins.
Cette recherche se fait dans les universités, les fondations et les laboratoires pharmaceutiques.
Le développement d’un vaccin est très encadré par l’Union Européenne. L’évaluation d’un vaccin est la même que celle des médicaments.
En fonction des maladies et du contexte, le développement d’un vaccin peut être très rapide (comme la Covid-19) ou très long (exemple du VIH/sida qui est encore en cours de recherche).

Déroulement de la recherche sur les vaccins
Avant de commencer les études chez l’homme, il est nécessaire de passer par une phase de test au laboratoire, puis chez différentes espèces animales. Elle permet :
- de déterminer les doses qui permettent de protéger sans entraîner de toxicité ;
- de vérifier que ce vaccin est sans danger aux doses utilisées ;
- de vérifier qu’il est efficace pour augmenter nos défenses immunitaires.
Les essais cliniques sont ensuite réalisés chez l’homme. Ces essais cliniques se déroulent en trois phases avant la commercialisation du vaccin. Ils ont pour objectif de déterminer la tolérance et l’efficacité du vaccin chez l’homme.
Pour pouvoir débuter, l'essai clinique doit avoir obtenu un avis favorable du Comité de protection des personnes (CPP) et une autorisation de l'Agence nationale de sécurité du médicament et des produits de santé (ANSM).
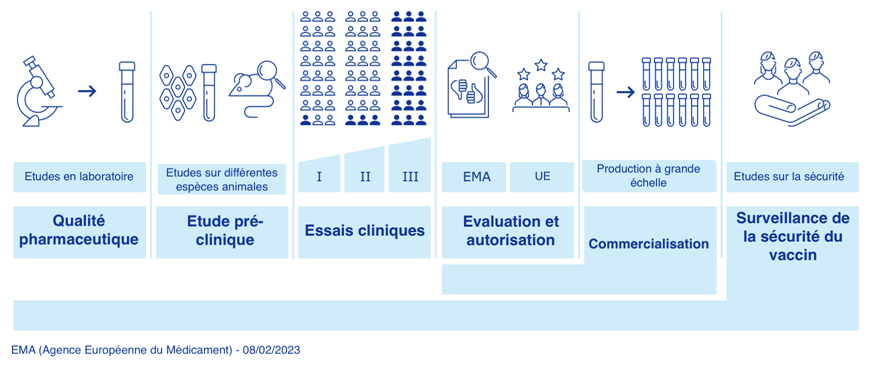
- Phase 1 : sur un petit nombre de personnes: elle se fait toujours chez l’adulte en bonne santé même si le vaccin concerne l’enfant. On étudie la tolérance et la production des anticorps.
- Phase 2 : sur un nombre plus important de personnes : on étudie la tolérance du vaccin et le nombre de doses retenues (schéma de vaccination) dans la population à laquelle cette vaccination sera recommandée.
- Phase 3 : sur plusieurs milliers de personnes :on étudie l’efficacité vaccinale et la tolérance.
Après la commercialisation du vaccin, l’Agence Nationale de Sécurité du Médicament (ANSM) va suivre l’efficacité et la tolérance du vaccin et va surveiller les effets secondaires plus rares.

